
Contente
- estágios
- Método 1 de 2: Balanceando uma equação pelo método de tentativa e erro
- Método 2 Equilibre uma equação pelo método algébrico
Na química, uma equação estabelece o que aconteceu durante uma reação química. À esquerda da equação, colocamos os reagentes que foram utilizados para o experimento e, à direita, os produtos obtidos durante o experimento. De acordo com o princípio de conservação da massa (Lavoisier) durante uma reação química, nenhum átomo desaparece, nenhum é criado, eles se combinam de maneira diferente. Em resumo, você deve ter o mesmo número de dados de cada elemento à direita e à esquerda da equação. É por isso que uma equação de equilíbrio deve sempre ser equilibrada.
estágios
Método 1 de 2: Balanceando uma equação pelo método de tentativa e erro
-
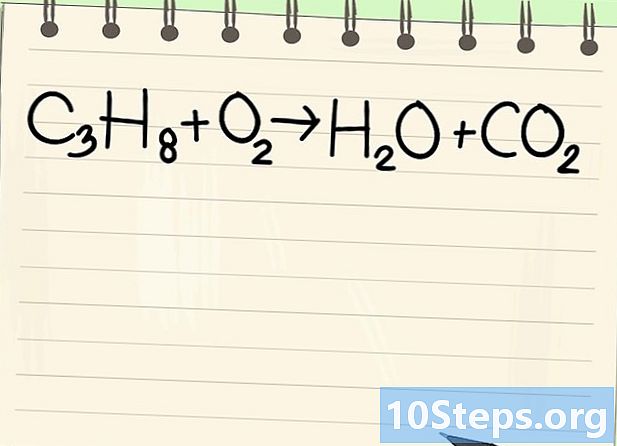
Observe a equação do balanço. Trataremos a seguinte equação:- C3H8 + O2 -> H2O + CO2
- Esta é a equação da combustão de propano (C3H8) em oxigênio: água e dióxido de carbono são obtidos.
-
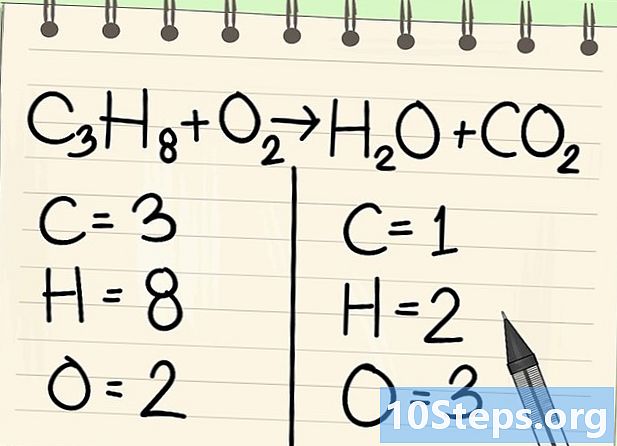
Conte os átomos. Digite o número de dados de cada elemento em um lado da equação e depois no outro. Para isso, leve em consideração os índices; se não houver, o índice será 1.- À esquerda, existem 3 átomos de carbono, 8 hidrogênio e 2 oxigênio.
- À direita, há 1 átomo de carbono, 2 de hidrogênio e 3 de oxigênio.
-
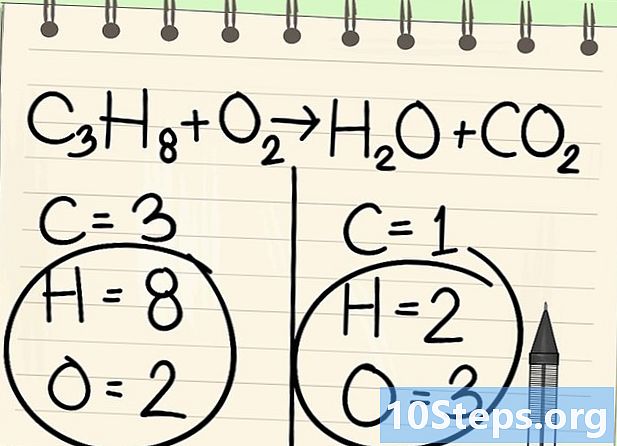
Deixe de lado momentaneamente o hidrogênio e o oxigênio. -

Comece a equilibrar com o elemento certo. Sempre começamos com o de uma molécula antes e depois da reação. Se houver vários, pegue o que é monovalente em uma das moléculas. Aqui começamos com os átomos de carbono. -

Equilibre os átomos de carbono. Adicione, à direita, um coeficiente à molécula de dióxido de carbono (CO2) em que o latoma do carbono está sozinho. Vamos colocar um 3 para obter os 3 átomos restantes.- C3H8 + O2 -> H2O + 3CO2
- Assim, temos 3 átomos de carbono à direita, graças ao coeficiente (3CO2) e 3 átomos de carbono à esquerda, graças ao índice (C3H8).
- Em uma equação, você pode colocar todos os coeficientes que deseja, mas não pode tocar nas pistas.
-
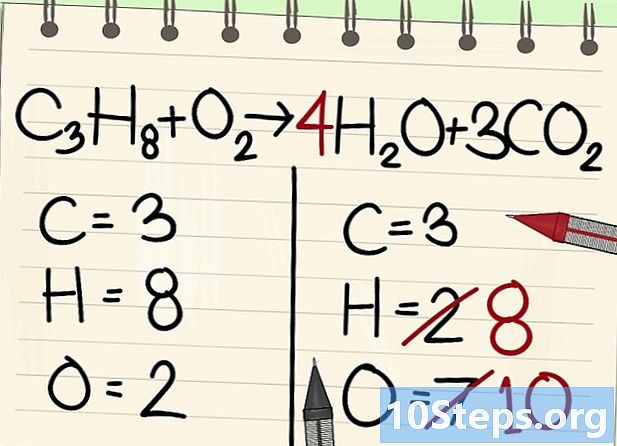
Equilibre os átomos de hidrogênio. Como você tem 8 à esquerda da equação, precisa tanto da direita.- C3H8 + O2 --> 4H2O + 3CO2
- À direita, você colocará um coeficiente de 4, porque o hidrogênio é bivalente na molécula de água: o índice 2 indica que dois átomos de hidrogênio estão associados.
- Para obter o número de átomos de hidrogênio à direita, multiplique o coeficiente 4 pelo índice 2 ou 8 átomos.
- Quanto aos átomos de oxigênio, à direita, existem agora 6 de um lado, provenientes das três moléculas de 3CO2 (3 x 2 = 6 átomos) e 4 das 4 moléculas de 4 H2O (4 x 1 = 4 átomos), ou seja, um total de 10 átomos de oxigênio.
-
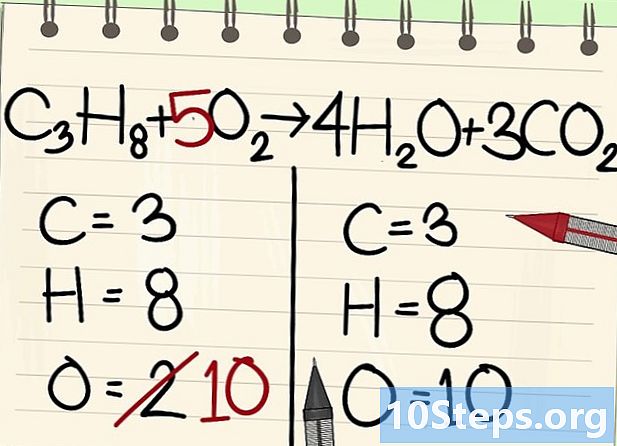
Equilibre os átomos de oxigênio.- Devido ao balanço de carbono e hidrogênio, o número de átomos de oxigênio não é o mesmo nos dois lados da equação. Vimos anteriormente que havia 10 átomos de oxigênio à direita (4 de moléculas de água e 6 de moléculas de dióxido de carbono). À esquerda, existem apenas 2 (de O2).
- Para equilibrar o oxigênio, adicione um coeficiente de 5 à molécula de oxigênio esquerda: você tem 10 átomos de oxigênio à esquerda e o outro à direita.
- C3H8 + 5O2 -> 4H2O + 3CO2
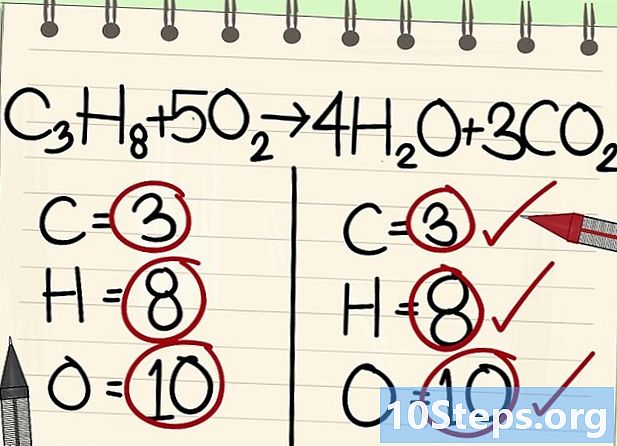
- Todos os átomos (carbono, hidrogênio e oxigênio) são equilibrados: sua equação é equilibrada.
Método 2 Equilibre uma equação pelo método algébrico
-

Escreva a equação para equilibrar. Atribua a cada molécula um coeficiente literal. Vamos chamá-los tem, b, c e d. -
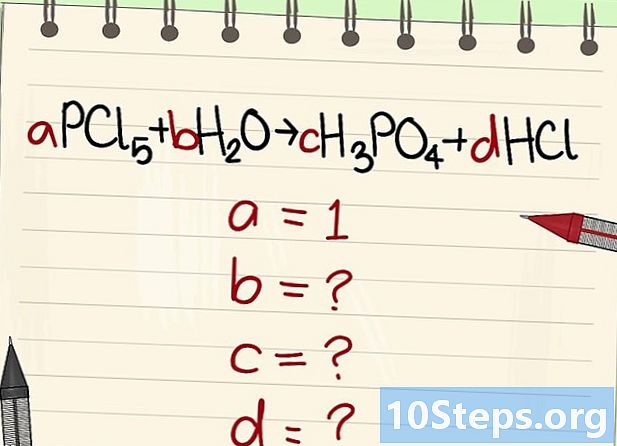
Encontre o valor dos outros coeficientes literais. Vamos pedir que tem = 1. -

Encontre os relacionamentos entre esses coeficientes. Olhando para a esquerda (reagentes) e para a direita (produtos), estabeleça as relações entre esses diferentes coeficientes.- Tome a seguinte equação: aPCl5 + bH2O = cH3PO4 + dHCl. Foi afirmado que a = 1, o que significa que c = a, d = 5a e 2b = 3c + d. Cálculos realizados, c = 1, d = 5 eb = 4.

- Tome a seguinte equação: aPCl5 + bH2O = cH3PO4 + dHCl. Foi afirmado que a = 1, o que significa que c = a, d = 5a e 2b = 3c + d. Cálculos realizados, c = 1, d = 5 eb = 4.


