Contente
Outras SeçõesNa quimica, elétrons de valência são os elétrons localizados na camada de elétrons mais externa de um elemento. Saber como encontrar o número de elétrons de valência em um átomo específico é uma habilidade importante para os químicos porque esta informação determina os tipos de ligações químicas que podem formar e, portanto, a reatividade do elemento. Felizmente, tudo que você precisa para encontrar os elétrons de valência de um elemento é uma tabela periódica padrão dos elementos.
Passos
Parte 1 de 2: Encontrando elétrons de valência com uma tabela periódica
Metais de não transição
Encontre um Tabela Periódica dos Elementos. Esta é uma tabela codificada por cores composta por muitos quadrados diferentes que lista todos os elementos químicos conhecidos pela humanidade. A tabela periódica revela muitas informações sobre os elementos - usaremos algumas dessas informações para determinar o número de elétrons de valência no átomo que estamos investigando. Normalmente, você pode encontrá-los na capa dos livros didáticos de química. Há também uma excelente mesa interativa disponível online aqui.

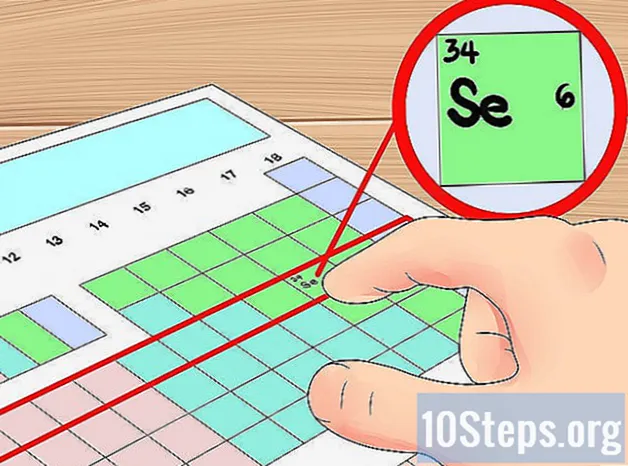
Identifique cada coluna na tabela periódica de elementos de 1 a 18. Geralmente, em uma tabela periódica, todos os elementos em uma única coluna vertical terão o mesmo número de elétrons de valência. Se sua tabela periódica ainda não tiver cada coluna numerada, dê a cada um um número começando com 1 para a extremidade esquerda e 18 para a extremidade direita. Em termos científicos, essas colunas são chamadas de elemento "grupos".- Por exemplo, se estivéssemos trabalhando com uma tabela periódica onde os grupos não são numerados, escreveríamos 1 acima do hidrogênio (H), 2 acima do berílio (Be) e assim por diante até escrever 18 acima do hélio (He) .

Encontre o seu elemento na mesa. Agora, localize o elemento para o qual deseja encontrar os elétrons de valência na mesa. Você pode fazer isso com seu símbolo químico (as letras em cada caixa), seu número atômico (o número no canto superior esquerdo de cada caixa) ou qualquer uma das outras informações disponíveis para você na mesa.- Por exemplo, vamos encontrar os elétrons de valência para um elemento muito comum: carbono (C). Este elemento tem um número atômico de 6. Ele está localizado no topo do grupo 14. Na próxima etapa, encontraremos seus elétrons de valência.
- Nesta subseção, iremos ignorar os metais de transição, que são os elementos no bloco em forma de retângulo feito pelos Grupos 3 a 12. Esses elementos são um pouco diferentes do resto, então as etapas nesta subseção ganharam ' t trabalhar neles. Veja como lidar com isso na subseção abaixo.

Use os números do grupo para determinar o número de elétrons de valência. O número do grupo de um metal não de transição pode ser usado para encontrar o número de elétrons de valência em um átomo desse elemento. o uns lugar do número do grupo é o número de elétrons de valência em um átomo desses elementos. Em outras palavras:- Grupo 1: 1 elétron de valência
- Grupo 2: 2 elétrons de valência
- Grupo 13: 3 elétrons de valência
- Grupo 14: 4 elétrons de valência
- Grupo 15: 5 elétrons de valência
- Grupo 16: 6 elétrons de valência
- Grupo 17: 7 elétrons de valência
- Grupo 18: 8 elétrons de valência (exceto hélio, que tem 2)
- Em nosso exemplo, uma vez que o carbono está no grupo 14, podemos dizer que um átomo de carbono tem quatro elétrons de valência.
Metais de transição
Encontre um elemento dos Grupos 3 a 12. Conforme observado acima, os elementos nos grupos 3 a 12 são chamados de "metais de transição" e se comportam de maneira diferente do resto dos elementos quando se trata de elétrons de valência. Nesta seção, explicaremos como, até certo ponto, muitas vezes não é possível atribuir elétrons de valência a esses átomos.
- Por exemplo, vamos escolher Tântalo (Ta), elemento 73. Nas próximas etapas, vamos encontrar seus elétrons de valência (ou, pelo menos, tentar para.)
- Observe que os metais de transição incluem as séries de lantanídeos e actinídeos (também chamados de "metais de terras raras") - as duas fileiras de elementos que geralmente são posicionados abaixo do resto da tabela que começam com lantânio e actínio. Todos esses elementos pertencem a grupo 3 da tabela periódica.
Entenda que os metais de transição não têm elétrons de valência "tradicionais". Entender por que os metais de transição não "funcionam" realmente como o resto da tabela periódica requer uma pequena explicação sobre a forma como os elétrons se comportam nos átomos. Veja abaixo uma revisão rápida ou pule esta etapa para ir direto às respostas.
- Conforme os elétrons são adicionados a um átomo, eles são classificados em "orbitais" diferentes - basicamente áreas diferentes ao redor do núcleo em que os elétrons se congregam. Geralmente, os elétrons de valência são os elétrons na camada mais externa - em outras palavras, os últimos elétrons adicionados .
- Por razões que são um pouco complexas para explicar aqui, quando os elétrons são adicionados ao d casca de um metal de transição (mais sobre isso abaixo), os primeiros elétrons que vão para a casca tendem a agir como elétrons de valência normais, mas depois disso, eles não o fazem, e elétrons de outras camadas orbitais às vezes agem como elétrons de valência. Isso significa que um átomo pode ter vários números de elétrons de valência, dependendo de como ele é manipulado.
Determine o número de elétrons de valência com base no número do grupo. Mais uma vez, o número do grupo do elemento que você está examinando pode informar seus elétrons de valência. No entanto, para os metais de transição, não há um padrão que você possa seguir - o número do grupo geralmente corresponderá a uma gama de números possíveis de elétrons de valência. Esses são:
- Grupo 3: 3 elétrons de valência
- Grupo 4: 2 a 4 elétrons de valência
- Grupo 5: 2 a 5 elétrons de valência
- Grupo 6: 2 a 6 elétrons de valência
- Grupo 7: 2 a 7 elétrons de valência
- Grupo 8: 2 ou 3 elétrons de valência
- Grupo 9: 2 ou 3 elétrons de valência
- Grupo 10: 2 ou 3 elétrons de valência
- Grupo 11: 1 ou 2 elétrons de valência
- Grupo 12: 2 elétrons de valência
- Em nosso exemplo, uma vez que o tântalo está no grupo 5, podemos dizer que ele tem entre dois e cinco elétrons de valência, dependendo da situação.
Parte 2 de 2: Encontrando elétrons de valência com uma configuração de elétrons
Aprenda a ler uma configuração eletrônica. Outra maneira de encontrar os elétrons de valência de um elemento é com algo chamado de configuração eletrônica. Eles podem parecer complicados à primeira vista, mas são apenas uma maneira de representar os orbitais do elétron em um átomo com letras e números e são fáceis quando você sabe o que está olhando.
- Vejamos um exemplo de configuração para o elemento sódio (Na):
- 1s2s2p3s
- Observe que esta configuração de elétrons é apenas uma sequência repetitiva que funciona assim:
- (número) (letra) (número) (letra) ...
- ...e assim por diante. o (número) (letra) pedaço é o nome do orbital de elétrons e é o número de elétrons nesse orbital - é isso!
- Então, para nosso exemplo, diríamos que o sódio tem 2 elétrons no orbital 1s mais 2 elétrons no orbital 2s mais 6 elétrons no orbital 2p mais 1 elétron no orbital 3s. Isso dá 11 elétrons no total - o sódio é o elemento número 11, então isso faz sentido.
- Lembre-se de que cada subcamada possui uma certa capacidade de elétrons. Suas capacidades de elétrons são as seguintes:
- s: capacidade de 2 elétrons
- p: capacidade de 6 elétrons
- d: capacidade de 10 elétrons
- f: capacidade de 14 elétrons
- Vejamos um exemplo de configuração para o elemento sódio (Na):
Encontre a configuração de elétrons para o elemento que você está examinando. Depois de conhecer a configuração eletrônica de um elemento, encontrar seu número de elétrons de valência é bastante simples (exceto, é claro, para os metais de transição.) Se você receber a configuração desde o início, poderá pular para a próxima etapa. Se você tiver que encontrar sozinho, veja abaixo:
- Examine a configuração eletrônica completa para oganesson (Og), elemento 118, que é o último elemento da tabela periódica. Ele tem o maior número de elétrons de qualquer elemento, então sua configuração eletrônica demonstra todas as possibilidades que você pode encontrar em outros elementos:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Agora que você tem isso, tudo o que você precisa fazer para encontrar a configuração de elétrons de outro átomo é apenas preencher esse padrão desde o início até ficar sem elétrons. Isto é mais facil do que parece. Por exemplo, se quisermos fazer o diagrama orbital do cloro (Cl), elemento 17, que tem 17 elétrons, faríamos assim:
- 1s2s2p3s3p
- Observe que o número de elétrons soma 17: 2 + 2 + 6 + 2 + 5 = 17. Você só precisa alterar o número no orbital final - o resto é o mesmo, pois os orbitais antes do final estão completamente cheios .
- Para obter mais informações sobre configurações de elétrons, consulte também este artigo.
- Examine a configuração eletrônica completa para oganesson (Og), elemento 118, que é o último elemento da tabela periódica. Ele tem o maior número de elétrons de qualquer elemento, então sua configuração eletrônica demonstra todas as possibilidades que você pode encontrar em outros elementos:
Atribuir elétrons a camadas orbitais com a regra do octeto. Conforme os elétrons são adicionados a um átomo, eles caem em vários orbitais de acordo com a ordem dada acima - os dois primeiros vão para o orbital 1s, os dois seguintes vão para o orbital 2s, os seis depois vão para o orbital 2p, e em breve. Quando estamos lidando com átomos fora dos metais de transição, dizemos que esses orbitais formam "camadas orbitais" em torno do núcleo, com cada camada sucessiva ficando mais para fora do que as anteriores. Além da primeira camada, que pode conter apenas dois elétrons, cada camada pode ter oito elétrons (exceto, novamente, quando se trata de metais de transição.) Isso é chamado de Regra do octeto.
- Por exemplo, digamos que estamos olhando para o elemento Boro (B). Como seu número atômico é cinco, sabemos que ele tem cinco elétrons e sua configuração eletrônica se parece com esta: 1s2s2p. Como a primeira camada orbital tem apenas dois elétrons, sabemos que o boro tem duas camadas: uma com dois elétrons 1s e outra com três elétrons dos orbitais 2s e 2p.
- Como outro exemplo, um elemento como o cloro (1s2s2p3s3p) terá três camadas orbitais: uma com dois elétrons 1s, uma com dois elétrons 2s e seis elétrons 2p e uma com dois elétrons 3s e cinco elétrons 3p.
Encontre o número de elétrons na camada mais externa. Agora que você conhece as camadas de elétrons do seu elemento, encontrar os elétrons de valência é fácil: basta usar o número de elétrons na camada mais externa. Se a camada externa estiver cheia (em outras palavras, se ela tiver oito elétrons ou, para a primeira camada, dois), o elemento é inerte e não reagirá facilmente com outros elementos. Novamente, no entanto, as coisas não seguem essas regras para metais de transição.
- Por exemplo, se estamos trabalhando com Boro, uma vez que existem três elétrons na segunda camada, podemos dizer que o Boro tem três elétrons de valência.
Use as linhas da tabela como atalhos de shell orbital. As linhas horizontais da tabela periódica são chamadas de elemento "períodos." Começando do topo da tabela, cada período corresponde ao número de cascas de elétrons os átomos no período possuem. Você pode usar isso como um atalho para determinar quantos elétrons de valência um elemento possui - basta começar do lado esquerdo de seu período ao contar os elétrons. Mais uma vez, você desejará ignorar os metais de transição com este método, que inclui os grupos 3-12.
- Por exemplo, sabemos que o elemento selênio tem quatro camadas orbitais porque está no quarto período. Uma vez que é o sexto elemento da esquerda no quarto período (ignorando os metais de transição), sabemos que a quarta camada externa tem seis elétrons e, portanto, que o selênio tem seis elétrons de valência.
Perguntas e respostas da comunidade
Como calculamos o elétron de valência?
Os elétrons de valência podem ser encontrados determinando as configurações eletrônicas dos elementos. Daí em diante, o número de elétrons na camada mais externa dá o número total de elétrons de valência naquele elemento.
Se um átomo tem 33 elétrons, quantos elétrons de valência existem?
Se o átomo não é um íon, podemos dizer que o átomo tem 33 prótons. Isso significa que é o elemento 33, que é o arsênico. Então sabemos que não é um metal de transição, então olhamos e descobrimos que o dígito da unidade de seu número de grupo é 5, o que significa que ele tem 5 elétrons de valência.
Como faço para determinar o número atômico do hélio?
O número de prótons é igual ao número atômico.
Por que os elétrons ganham carga negativa e não carga positiva?
Os átomos ganham ou perdem elétrons, cargas negativas, porque os prótons têm carga positiva e são mantidos no núcleo pela força nuclear forte. Esta é uma das quatro forças distintas no Universo: gravidade, eletromagnetismo, a força fraca e a força nuclear forte. Tem que ser forte porque os prótons se repelem, ainda que estejam realmente próximos no núcleo (junto com os nêutrons, também mantidos pela força forte). A ideia é que a força forte é extremamente forte, mas apenas em distâncias muito pequenas. Pense em pequenos ganchos super fortes. Para fazer com que prótons e nêutrons se conectem, você precisa de forças como a imensa gravidade de uma estrela, uma supernova ou uma explosão nuclear.
Qual é o elétron de valência dos gases nobres?
Os gases nobres têm oito elétrons de valência - o estado mais estável para um elemento.
Por que o nitrogênio tem 6 elétrons de valência, mas está no grupo 15?
O nitrogênio tem apenas cinco elétrons de valência porque está no grupo 5, embora na verdade esteja no grupo 15, você vai ignorar os metais de transição porque esses grupos têm maneiras diferentes de determinar seus elétrons de valência. Portanto: grupo 13 significa grupo 3 e assim por diante.
Um átomo tem 7 prótons, 8 neurônios e 7 elétrons. Qual é o número de elétrons em sua camada de valência?
O elemento que contém 7 prótons é o nitrogênio. O nitrogênio está na coluna de elementos que possui 5 elétrons na camada de valência. O número de nêutrons é irrelevante para encontrar o número de elétrons de valência em um elemento específico.
Onde na Tabela Periódica estão localizados os átomos com sete elétrons da camada externa?
Observe a penúltima coluna do lado direito, ao lado dos gases inertes.
O que é um elétron de valência?
Um elétron de valência é um elétron que se encontra na parte mais externa de um átomo e pode ser compartilhado ou obtido em uma reação.
Por que os elementos da tabela periódica têm números diferentes de elétrons de valência?
Eles têm diferentes estruturas químicas. Os elétrons de valência são o que criam reações químicas.
Dicas
- Observe que as configurações de elétrons podem ser escritas em uma espécie de abreviatura usando gases nobres (os elementos do grupo 18) para substituir os orbitais no início da configuração. Por exemplo, a configuração do elétron do sódio pode ser escrita 3s1 - essencialmente, é o mesmo que o neon, mas com mais um elétron no orbital 3s.
- Os metais de transição podem ter subcamadas de valência que não estão completamente preenchidas. Determinar o número exato de elétrons de valência em metais de transição envolve princípios da teoria quântica que estão além do escopo deste artigo.
- Observe que as tabelas periódicas diferem de país para país. Portanto, verifique se você está usando o correto e atualizado para evitar confusão.
- Certifique-se de saber quando adicionar ou subtrair do último orbital para encontrar elétrons de valência.
Coisas que você precisa
- Tabela Periódica dos Elementos
- Lápis
- Papel
Todos os dias no wikiHow, trabalhamos duro para dar a você acesso a instruções e informações que irão ajudá-lo a viver uma vida melhor, seja para mantê-lo mais seguro, saudável ou melhorando seu bem-estar. Em meio às atuais crises econômicas e de saúde pública, quando o mundo está mudando drasticamente e todos nós estamos aprendendo e nos adaptando às mudanças na vida diária, as pessoas precisam do wikiHow mais do que nunca. Seu apoio ajuda o wikiHow a criar artigos e vídeos ilustrados mais detalhados e a compartilhar nossa marca confiável de conteúdo instrucional com milhões de pessoas em todo o mundo. Por favor, considere fazer uma contribuição ao wikiHow hoje.